Introdução
A pele e os micro-organismos
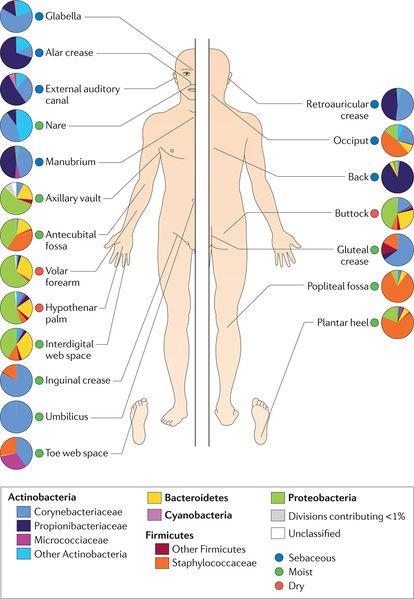
A pele é o maior órgão do corpo e constitui mais de 1,8 metros quadrados de área de superfície na qual micro-organismos podem formar habitats (Figura 1). Bactérias, fungos, vírus e eucariotos microbianos são todos habitantes comuns dessa interação com o ambiente externo. Semelhante a qualquer ecossistema, o micro-bioma da pele contém organismos simbióticos de muitas naturezas diferentes - muitos são inofensivos, outros são benéficos para a saúde humana, e alguns são patogênicos e facilitam a doença.
Micro-organismos patogênicos associados a pele humana têm sido estudados. É possível citar Staphylococcus aureus e Streptococcus pyogenes, por exemplo, que causam infecções dermatológicas e uma variedade de outras doenças e são, provavelmente, dois dos os patógenos microbianos mais estudados na pele humana.
As bactérias que habitam a pele também atuam como produtores de odores, que podem desempenhar papel importante nas interações entre vetores de doenças (por exemplo, mosquitos, triatomíneos, ácaros, carrapatos) e seus hospedeiros humanos. A olfação é o principal sentido com o qual muitos vetores localizam seus hospedeiros sanguíneos e, portanto, sinais químicos afetam a transmissão da doença
A microbiota humana
Desde que ferramentas moleculares se tornaram disponíveis, tem havido um enorme aumento do conhecimento sobre a ecologia da microbiota humana.
A microbiota do intestino humano provou ser uma comunidade complexa de muitas espécies diferentes e desempenha papel importante na saúde e doença. Após algum desequilíbrio, os probióticos podem ajudar a restaurar populações intestinais e, assim, restaurar a função do trato intestinal.
Em contraste com a microbiota intestinal, até recentemente, pouco se sabia sobre a comunidade microbiana da pele humana. A partir do uso das técnicas moleculares, foi possível demonstrar a complexidade da comunidade microbiana na pele e que os seres humanos diferem fortemente em seus perfis de microbiota cutânea. Esse conhecimento pode ajudar a desvendar alguns dos aspectos básicos funções dos microrganismos na pele humana.
Produção volátil de microbiota no pele humana
O suor humano é inodoro e só recebe o seu cheiro característico após incubação de bactérias. A microbiota da pele desempenha um papel importante na produção de odores e o número de determinados microrganismos estão fortemente correlacionados com a intensidade do odor emitido. Os micro-organismos da pele humana são mais abundantes na proximidades das glândulas, onde metabolizam as secreções da pele (fig. 2).
As glândulas da pele humana podem ser divididas em sebáceas e glândulas sudoríparas (Fig. 2). As glândulas sebáceas produzem sebo, que consiste em lipídios e células mortas (Figs. 2 e 3)(Stoddart, 1990). As glândulas sudoríparas incluem glândulas écrinas e apócrinas e produzem principalmente água (Fig. 2 e 3). As glândulas écrinas estão localizadas em todo o corpo (Fig. 2) e produzir suor para resfriar o corpo pela perda de calor por evaporação quando a temperatura aumenta. Glândulas apócrinas são principalmente encontrados na região axilar, e são hipoteticamente papel na produção de feromonas humanas (Stoddart, 1990). Quando as secreções apócrinas frescas são esterilizadas, elas são inodoro (Shelley et al., 1953).
Para identificar quais bactérias são responsáveis pela produção de odor humano, Leyden et al. (1981) comparou o microbiologia da axila de 229 seres humanos com a intensidade do seu odor axilar. Corynebacteria foram encontrados ser responsável pelo odor apócrino típico. Isto foi confirmado por outros estudos (Jackman & Noble, 1983; Rennie et al.f 1991; Taylor et al., 2003), embora uma associação com o número total de pacientes bactérias e o número de micrococos na pele também foi sugerido.
 |
| Figura 3. |
A maioria dos estudos investigou a relação entre odor axilar e composição da microbiota e, portanto, focado no suor apócrino. Os pés são uma importante fonte de odor corporal humano e contêm altos números de glândulas écrinas (Fig. 2). O aumento do odor do pé está associado a maiores densidades populacionais de microrganismos com lipase e atividade proteinase (Marshall et al., 1987) e / ou superior números de espécies de Bacillus (Ara et al., 2006). O couro cabeludo humano tem alta densidade de glândulas sebáceas. Glândulas sebáceas contêm numerosas propionibactérias que hidrolisam triglicerídeos em ácidos graxos voláteis.
Após uma correlação entre a produção de odor e a composição bacteriana, os estudos in vitro revelaram os mecanismos subjacentes da produção de odores por espécies bacterianas específicas. Gower et al. (1994) mostrou que
Após uma correlação entre a produção de odor e a composição bacteriana, os estudos in vitro revelaram os mecanismos subjacentes da produção de odores por espécies bacterianas específicas. Gower et al. (1994) mostrou que
A 5a-androstenona, que é sugerida para contribuir para o odor axilar em homens, é produzida por duas cepas bacterianas corynefor quando fornecidas in vitro com quatro amostras não-voláteis
16-androstenos. Corynebacteria também desempenham um papel crucial a geração de ácidos graxos voláteis, que estão associados com mau odor (James et al., 2004).
Os genomas completos das espécies bacterianas da pele
Bacillus subtilis (Kunst et al., 1997), Corynebacterium jeikeium (Tauch et al., 2005), Propionibacterium acnes (Bruggemann et al., 2004) e Staphylococcus aureus (Kuroda et al., 2001) foram sequenciados. Um próximo passo será vincular essas seqüências para as vias e mecanismos de odor produção por essas bactérias na pele humana. Enzimas bacterianas envolvidas na produção de odores, por conversão de compostos não voláteis em compostos voláteis, foram identificados e seus genes trazidos para expressão em Escherichia coli (Natsch et al., 2003, 2004). Enzimas específicas produtoras de odor podem ser bloqueadas por inibidores, que possuem uma maior afinidade pela enzima do que o substrato original (Ara et al., 2006)
Os genomas completos das espécies bacterianas da pele
Bacillus subtilis (Kunst et al., 1997), Corynebacterium jeikeium (Tauch et al., 2005), Propionibacterium acnes (Bruggemann et al., 2004) e Staphylococcus aureus (Kuroda et al., 2001) foram sequenciados. Um próximo passo será vincular essas seqüências para as vias e mecanismos de odor produção por essas bactérias na pele humana. Enzimas bacterianas envolvidas na produção de odores, por conversão de compostos não voláteis em compostos voláteis, foram identificados e seus genes trazidos para expressão em Escherichia coli (Natsch et al., 2003, 2004). Enzimas específicas produtoras de odor podem ser bloqueadas por inibidores, que possuem uma maior afinidade pela enzima do que o substrato original (Ara et al., 2006)
Diversidade inter e intrapessoal na pele microbiota
Como discutido, a produção de odores na pele humana é em parte
uma função da composição da microbiota da pele. Porque o perfil de odor humano é pelo menos parcialmente geneticamente com base, pode-se esperar que a variação intrapessoal no composição da microbiota ao longo do tempo é menor que a variação interpessoal. Isto foi de fato mostrado para a composição da microbiota fecal (Holdeman et al., 1976; Eckburg et al., 2005), mas estudos que investigam variações intra e interpessoais de microrganismos da pele têm sido raros.
Bactérias voláteis da pele humana e as interações vetor - hospedeiro
Várias famílias de insetos atuam como vetores de doenças nocivas, como como malária, leishmaniose, cegueira dos rios e vírus do Nilo Ocidental (Takken & Knols, 1999; Resh et al., 2004; Reisen et al., 2005; Kamhawi, 2006). Esses vetores localizam seus hospedeiros sanguíneos, incluindo seres humanos, à distância, usando pistas olfativas produzidos por seus anfitriões (Takken & Knols, 1999; Logan & Birkett, 2007). Estudos recentes demonstraram o papel da pele microbiota nas interações entre vetores de doenças e seus hospedeiros sanguíneos (Braks & Takken, 1999; Verhulst et al., 2009; Ortiz & Molina, 2010) e o conhecimento da pele humana.
A atratividade humana para os mosquitos pode mudar quando indivíduos estão infectados com parasitas do Plasmodium que causa malária (Lacroix et al., 2005; Mukabana et al., 2007). Crianças portadoras de gametócitos do Plasmodium atraídas cerca de duas vezes mais mosquitos do que crianças sem infecção ou com parasitas no estágio assexual (Lacroix et al., 2005). Esse aumento da atratividade das crianças infectadas poderia ser explicado por um aumento da temperatura corporal, aumento da transpiração ou alteração da composição da respiração. Contudo, é menos provável que esses fatores estejam envolvidos em a mudança observada na atratividade, pois a infecção foi assintomático em todas as crianças envolvidas (Lacroix et al., 2005). Resta investigar se uma infecção com Plasmodium afeta a composição e / ou o número de bactérias da pele. Nesse caso, pode ser um adicional explicação para o aumento da atratividade para a malária mosquitos (Fig. 4)
Bactérias voláteis da pele humana e as interações vetor - hospedeiro
Várias famílias de insetos atuam como vetores de doenças nocivas, como como malária, leishmaniose, cegueira dos rios e vírus do Nilo Ocidental (Takken & Knols, 1999; Resh et al., 2004; Reisen et al., 2005; Kamhawi, 2006). Esses vetores localizam seus hospedeiros sanguíneos, incluindo seres humanos, à distância, usando pistas olfativas produzidos por seus anfitriões (Takken & Knols, 1999; Logan & Birkett, 2007). Estudos recentes demonstraram o papel da pele microbiota nas interações entre vetores de doenças e seus hospedeiros sanguíneos (Braks & Takken, 1999; Verhulst et al., 2009; Ortiz & Molina, 2010) e o conhecimento da pele humana.
A atratividade humana para os mosquitos pode mudar quando indivíduos estão infectados com parasitas do Plasmodium que causa malária (Lacroix et al., 2005; Mukabana et al., 2007). Crianças portadoras de gametócitos do Plasmodium atraídas cerca de duas vezes mais mosquitos do que crianças sem infecção ou com parasitas no estágio assexual (Lacroix et al., 2005). Esse aumento da atratividade das crianças infectadas poderia ser explicado por um aumento da temperatura corporal, aumento da transpiração ou alteração da composição da respiração. Contudo, é menos provável que esses fatores estejam envolvidos em a mudança observada na atratividade, pois a infecção foi assintomático em todas as crianças envolvidas (Lacroix et al., 2005). Resta investigar se uma infecção com Plasmodium afeta a composição e / ou o número de bactérias da pele. Nesse caso, pode ser um adicional explicação para o aumento da atratividade para a malária mosquitos (Fig. 4)
Referências
Grice, E & Segre, J (2016). "The skin microbiome". Disponível em: https://www.ncbi.nlm.nih.gov/pubmed/21407241
Bisno AL & Stevens DL (1996) Streptococcal infections of skin
and soft tissues. New Engl J Med 334: 240–246.
Kluytmans J, van Belkum A & Verbrugh H (1997) Nasal carriage
of Staphylococcus aureus: epidemiology, underlying
mechanisms, and associated risks. Clin Microbiol Rev 10:
505–520.
Logan JG & Birkett MA (2007) Semiochemicals for biting fly
control: their identification and exploitation. Pest Manag Sci
63: 647–657.
Gao Z, Tseng C-h, Pei Z & Blaser MJ (2007) Molecular analysis of
human forearm superficial skin bacterial biota. P Natl Acad Sci
USA 104: 2927–2932.
Grice EA, Kong HH, Conlan S et al. (2009) Topographical and
temporal diversity of the human skin microbiome. Science
324: 1190–1192.
Costello EK, Lauber CL, Hamady M, Fierer N, Gordon JI &
Knight R (2009) Bacterial community variation in human
body habitats across space and time. Science 326: 1694–1697.
Vrieze A, Holleman F, Zoetendal E, de Vos W, Hoekstra J &
Nieuwdorp M (2010) The environment within: how gut
microbiota may influence metabolism and body composition.
Diabetologia 53: 606–613
Egert M, de Graaf AA, Smidt H, de Vos WM & Venema K (2006) Beyond diversity: functional microbiomics of the human colon. Trends Microbiol 14: 86–91.
Rastall RA, Gibson GR, Gill HS, Guarner F, Klaenhammer TR, Pot B, Reid G, Rowland IR & Sanders ME (2005) Modulation of the microbial ecology of the human colon by probiotics, prebiotics and synbiotics to enhance human health: an overview of enabling science and potential applications. FEMS Microbiol Ecol 52: 145–152.
Ouwehand A, Salminen S & Isolauri E (2002) Probiotics: an overview of beneficial effects. Antonie van Leeuwenhoek 82: 279–289.
Leyden JJ, McGinley KJ, Holzle E, Labows JN & Kligman AM (1981) The microbiology of the human axilla and its relationship to axillary odor. J Invest Dermatol 77: 413–416
Jackman PJH & Noble WC (1983) Normal axillary skin in various populations. Clin Exp Dermatol 8: 259–268.
Rennie PJ, Gower DB, Holland KT, Mallet AI & Watkins WJ (1990) The skin microflora and the formation of human axillary odor. Int J Cosmet Sci 12: 197–207.
Rennie PJ, Gower DB & Holland KT (1991) In-vitro and in-vivo studies of human axillary odor and the cutaneous microflora. Brit J Dermatol 124: 596–602.
Taylor D, Daulby A, Grimshaw S, James G, Mercer J & Vaziri S (2003) Characterization of the microflora of the human axilla. Int J Cosmet Sci 25: 137–145.
Ara K, Hama M, Akiba S, Koike K, Okisaka K, Hagura T, Kamiya T & Tomita F (2006) Foot odor due to microbial metabolism and its control. Can J Microbiol 52: 357–364.
Stoddart DM (1990) The Scented Ape: The biology and Culture of Human Odour. Cambridge University Press, Cambridge, UK.






Nenhum comentário:
Postar um comentário